
是一种选择性自噬,其通过Atg8/LC3-核糖体自噬受体相互作用,将待降解的核糖体包裹并运送至液泡/溶酶体进行降解。在酿酒酵母(Saccharomyces cerevisiae)中,泛素蛋白酶复合体Ubp3p/Bre5p已被发现参与核糖体自噬过程。然而,酵母中的核糖体自噬受体仍未被鉴定。在哺乳动物细胞中,David Sabatini课题组鉴定了NUFIP1作为核糖体自噬受体。他们发现,在氨基酸饥饿条件下,NUFIP1从细胞核转位到核糖体,并通过与LC3B的结合,将核糖体招募至自噬体,最终在溶酶体内降解。然而,最近哈佛大学医学院Wade Harper课题组和北京大学医学部赵颖课题组的研究发现,NUFIP1的敲除并不会阻碍哺乳动物细胞在饥饿条件下的核糖体蛋白降解。此外,生物信息学分析表明,NUFIP1在酵母和线虫中并无同源基因,课题组前期的实验结果也表明,果蝇中的 NUFIP1不参与核糖体自噬。这些证据强烈表明,从酵母到哺乳动物,可能存在一个更加保守且更为关键的核糖体自噬受体。

浙江大学基础医学院易聪课题组联合多个课题组在 Nature Cell Biology 期刊上在线发表了题为 “Rpl12 is a conserved ribophagy receptor” 的研究论文。该研究证实了核糖体大亚基蛋白Rpl12 是一个从酵母到哺乳动物都高度保守的核糖体自噬受体,并揭示了一条触发核糖体自噬的信号通路:在饥饿条件下,被激活的蛋白激酶 Atg1通过磷酸化 Rpl12, 促进其与选择性自噬适配蛋白 Atg11的 结合,从而触发核糖体自噬。进一步的功能分析表明,Rpl12 介导的核糖体自噬在生物体的生长、发育及寿命调控中发挥了重要作用。值得一提的是,Nature Cell Biology期刊同期还配发了View & News的评论文章“Ribophagy relies on Rpl12”,高度评价了这项工作。
| 产品 | 名称 |
|---|---|
|
制 兔 多 克 隆 抗 体 |
Rps2 Rabbit polyclonal Antibody |
| Rps5 Rabbit polyclonal Antibody | |
| Rpl12 Rabbit polyclonal Antibody | |
| Rpl25 Rabbit polyclonal Antibody | |
| Rpl38 Rabbit polyclonal Antibody | |
| Rps13 Rabbit polyclonal Antibody | |
| Rpl26 Rabbit polyclonal Antibody | |
| Rpl27 Rabbit polyclonal Antibody | |
| Rps14 Rabbit polyclonal Antibody | |
| Rps25 Rabbit polyclonal Antibody | |
| Rps27 Rabbit polyclonal Antibody | |
| Rpl3 Rabbit polyclonal Antibody |

该研究首先通过生物信息学分析发现,NUFIP1 在酵母和线虫中缺乏同源物,表明 NUFIP1 介导的核糖体自噬可能是哺乳动物特有的机制。为了鉴定更为保守的核糖体自噬受体,研究团队结合 GST-pulldown、质谱分析及酵母双杂交等实验手段,鉴定出 Rpl12 作为一个在多个物种中高度保守的核糖体自噬受体,并确定其与 Atg8/LC3 蛋白家族成员结合的两个关键氨基酸位点。此外,研究还发现 Rpl12 介导的核糖体自噬在适应饥饿和抵御外源性病原体感染方面发挥了重要作用;Rpl12介导的核糖体自噬缺陷会导致线虫和果蝇的生长受损、发育异常以及寿命缩短。在饥饿条件下,果蝇肌肉组织中的核糖体自噬显著增强,而Rpl12介导的核糖体自噬缺陷会加剧因饥饿或衰老引发的运动障碍。此外,Rpl12 过表达显著提高了果蝇对外源性病原体感染的抵抗能力,并延长了寿命,同时缓解了因饥饿、衰老或 Aβ 积累导致的运动缺陷。这些研究结果表明,Rpl12 介导的核糖体自噬在调控核糖体降解、维持细胞稳态及环境应激方面发挥了关键作用。
实验结果
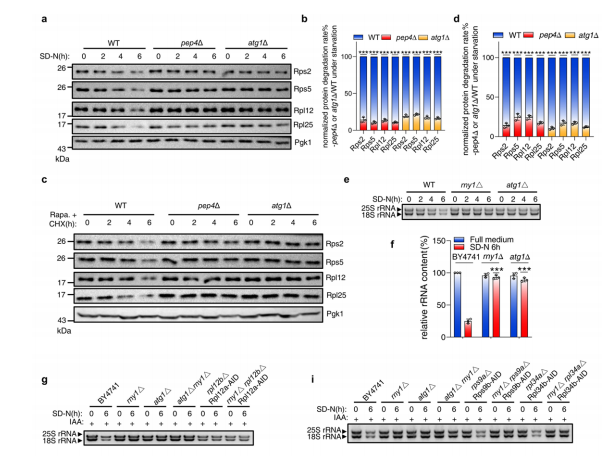
a.指定酵母细胞经SD-N处理指定时间后,通过western印迹分析蛋白水平。
b.量化(a)中蛋白质的降解率。
c.野生型、pep4∆或atg1∆酵母细胞培养至对数中期,用100µg/ml环己酰亚胺(CHX)预处理1小时,随后分别用0.2µg/ml雷帕霉素处理0、2、4和6小时。核糖体蛋白通过western印迹分析。
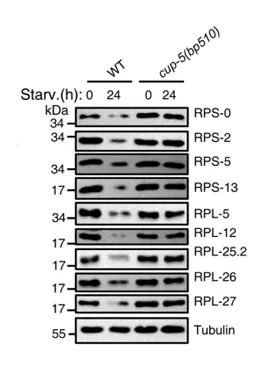
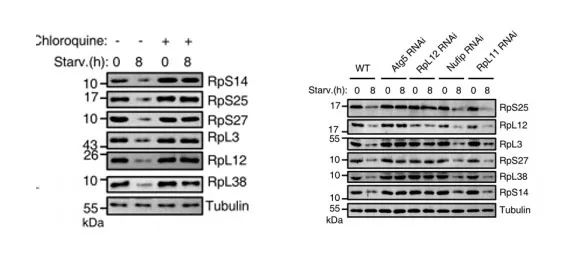
图3.左图为用氯喹处理后,分析核糖体蛋白水平,并饥饿8小时;右图为饥饿处理后,核糖体蛋白水平。
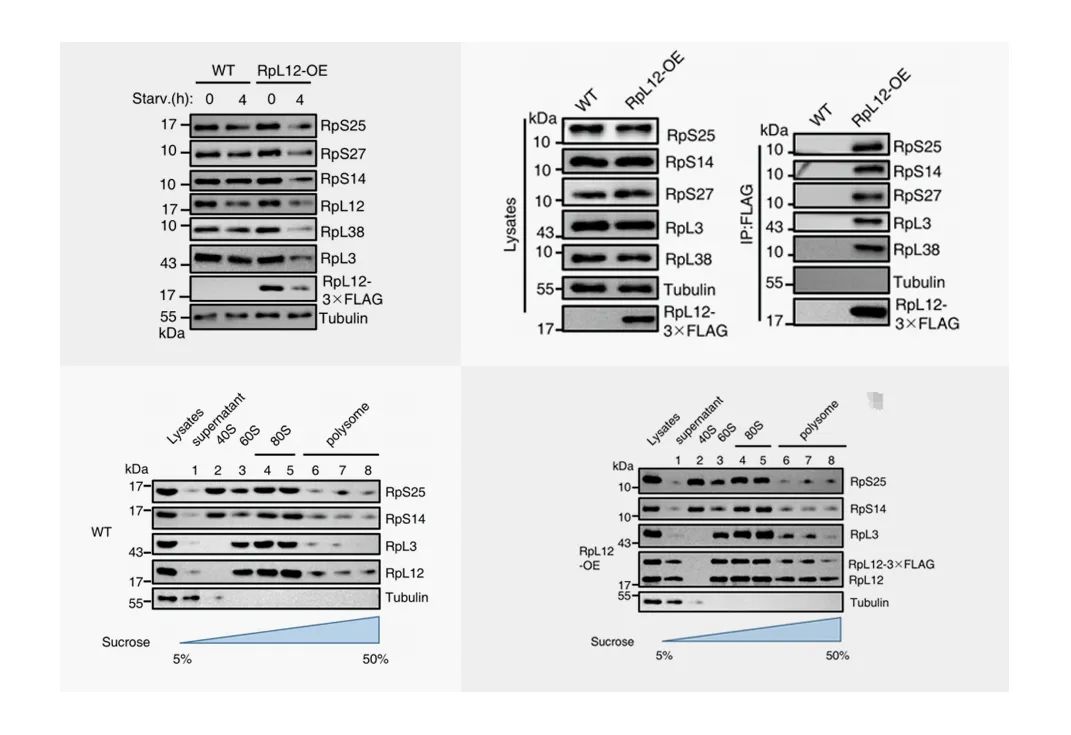
图4.左上为WT小鼠和过表达RpL12-3×FLAG的小鼠在饥饿0小时或4小时后,通过测定饥饿前后核糖体蛋白水平来评估核糖体吞噬活性;
右上为用抗FLAG琼脂糖珠免疫沉淀细胞裂解物,并用指定抗体进行分析;
左下右下图为对分离出的组分使用指定的抗体进行western印迹分析。
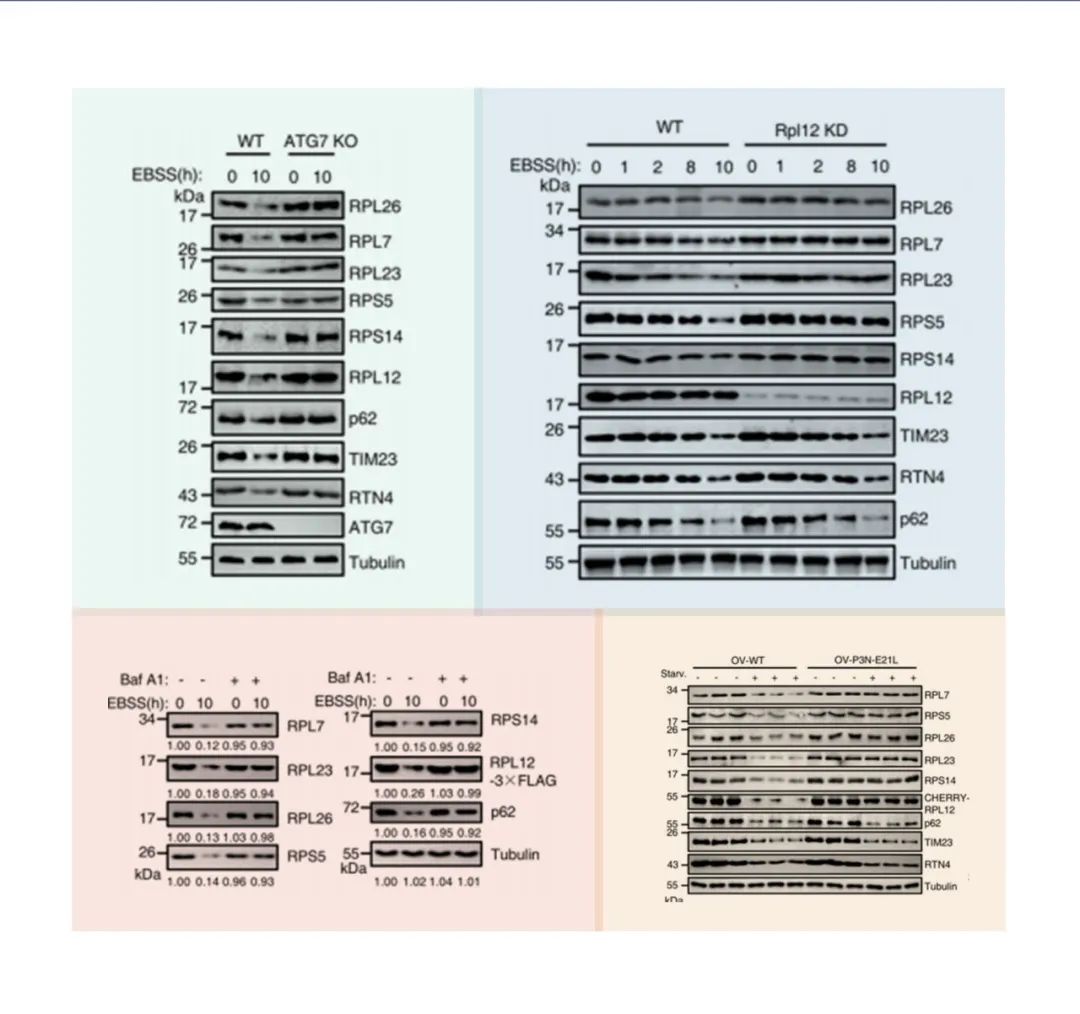
图5.左上是WT和ATG7敲除HEK 293 T细胞用EBSS饥饿0小时或10小时,Western blot分析评估蛋白水平;
右上为WT和Rpl12 KD稳定的HEK293T细胞饥饿10小时后,通过核糖体蛋白降解的western blot来评估核糖体自噬活性;
左下为将RPL12-3×FLAG质粒转染进RPL12敲低细胞,并用EBSS单独处理或EBSS与巴非霉素A1联合处理0或10 h后,通过Western blot分析蛋白样品;
右下为腹腔注射mCherry标记的rAAV-RPL12-WT或rAAV-RPL12 P3N-E21L后,评估饥饿状态下小鼠肝脏中核糖体蛋白和其他指示蛋白的表达水平(n = 3只小鼠)。
文献来源:DOI: 10.1038/s41556-024-01598-2
来源:浙江大学医学院易聪课题组供稿

公司主要产品有抗体制备全套产品、病毒包装 相关产品、2万多种科研用抗原抗体、近300 种病理级抗体、几千种重组蛋白,另有WB、 IHC、ELISA、细胞培养相关试剂及诸多特色 产品和特色技术服务。
 电话咨询
电话咨询
 在线咨询
在线咨询
 QQ
QQ
 二维码
二维码
 扫码二维码
扫码二维码